Растворенное состояние веществ. Что такое растворитель и растворенное вещество
Растворенное состояние веществ
ПРОЦЕССЫ ИНЖЕНЕРНОЙ ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ
Как в природе, так и в технике постоянно приходится иметь дело с веществами-растворами, содержащими примеси, а не с чистыми веществами.
Раствор - это однородная смесь, состоящая из двух или более веществ и продуктов их взаимодействия, состав которой в определенных пределах может непрерывно изменяться. Частицы, составляющие растворную смесь, весьма малы и имеют молекулярные, атомные или ионные размеры.
Составляющие растворов (компоненты) условно делят на растворитель и растворенное вещество. Они равноценны. Растворителем принято считать тот компонент, которого в растворе больше.
В общем случае термин «раствор» может относиться к любому агрегатному состоянию системы. Это газовые смеси, жидкие и твердые растворы.
Растворимость - это способность вещества переходить в раствор (водный или другого растворителя). В растворении могут участвовать твердые, жидкие и газообразные вещества. Растворение - самопроизвольный процесс. Рассмотрим его на примере водных растворов.
По растворимости в воде все вещества делятся на: хорошо растворимые, малорастворимые и практически нерастворимые. К последним относятся, например, стекло, серебро, золото, другие металлы (твердые вещества), нефть и продукты ее переработки, растительное масло (жидкости), инертные и другие однокомпонентные газы, метан и т. п. Малорастворимы многие горные породы (известняки, гипсы, руды), жидкости (ацетон), газы (сернистый водород). Хорошо растворимыми являются, в частности, сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, аммиак и др. Даже в последнем случае может наступить равновесие между массой вещества, переходящего в раствор и выпадающего из него, т. е. достигается насыщение раствора. Насыщенный раствор - это раствор, находящийся в динамическом равновесии с избытком растворяемого вещества. В некоторых случаях (жидкости типа вода - спирт и др.) вещества обладают полной взаимной растворимостью по отношению друг к другу, и насыщение раствора не наступает.
Различают также ненасыщенные и пересыщенные растворы. Очевидно, что в ненасыщенном растворе содержится меньше вещества, а в пересыщенном - больше, чем в насыщенном. Пересыщенные растворы весьма неустойчивы и образуются в специальных условиях, например при медленном и осторожном охлаждении растворов в отсутствие частиц примесей, которые послужили бы центрами кристаллизации, зародышами. Простое сотрясение сосуда или введение в раствор кристаллика соды (зародыша) вызывает выпадение в осадок избытка растворенного вещества. Пересыщенные растворы образуют, например, сахароза, кристаллогидраты солей (^ЭДхЮ^О, N^&Ovx ЮН2О и др.).
Количественно растворимость выражается концентрацией насыщенного раствора, т. е. максимальным числом граммов вещества, которое при данной температуре можно растворить в 100 г растворителя. Растворимость твердых веществ с увеличением температуры обычно возрастает. Однако растворимость некоторых из них при повышении температуры практически не изменяется (хлориды натрия или алюминия) или даже уменьшается (гидроксид кальция, сульфат лития и др.).
При понижении температуры развиваются обратные процессы, т. е. растворенное вещество, как правило, выпадает из раствора. Этот процесс называется кристаллизацией. Если в растворе, помимо растворенного вещества, содержатся и другие (примеси), то по отношению к ним раствор будет оставаться ненасыщенным, и они не выпадут в осадок. На этом основан метод очистки веществ, называемый перекристаллизацией.
Растворение веществ в воде может быть чисто физическим процессом или содержать элементы химического взаимодействия.
Чисто физические процессы имеют место в тех случаях, когда компоненты раствора в исходном состоянии (в виде самостоятельных фаз) мало разнятся между собой по свойствам, молекулы их достаточно близки по размерам и структуре. В подобных растворах молекулы каждого компонента существуют в условиях, мало отличающихся от тех, в которых они находятся в чистом компоненте. Образование подобных растворов не сопровождается ни тепловыми эффектами, ни изменением объема. Такие растворы называют идеальными. Их роль в теории растворов во многом аналогична месту идеальных газов в учении о газах.
Зависимости свойств идеального раствора от его состава и концентрации наиболее просты. В частности, давление pi насыщенного пара растворенного вещества над идеальным раствором подчиняется закону Рауля (1887 г.):
PI= P?-Nh (1.16)
Где - давление насыщенного пара над чистым i-м компонентом; Ni - мольная доля i-го вещества в растворе.
Установлено также, что понижение температуры ДТкр кристаллизации таких растворов пропорционально концентрации С растворенного вещества:
ДТ = KC. (1.17)
Соответственно повышение температуры Ткип кипения идеальных растворов пропорционально концентрации C раствора:
ДТКип = EC (1.18)
В соответствии с теорией электролитической диссоциации, основные положения которой разработал шведский ученый С. Аррениус (1887 г.), вещества при растворении в воде или плавлении частично или полностью распадаются (диссоциируют) на ионы. При значительной степени диссоциации растворов (расплавов) они являются хорошими проводниками электрического тока (электролитами).
Чистая вода часто рассматривается как вещество, практически не диссоциирующее на ионы. Однако в действительности и она, хотя и в малой степени, диссоциирует на ионы H и ОН, которые находятся в равновесии с диссоциирующими молекулами:
h3O ^^ H + OH - Q. (1.19)
При этом мольные (нормальные) концентрации ионов Н и ОН в воде равны друг другу.
В более общем случае равновесие между исходными и конечными продуктами химического взаимодействия характеризуется константой равновесия. Применительно к диссоциации раствора константа равновесия называется константой диссоциации KD, которая выражается через активность а:
Kd = ан+аон-/ан2О. (1.20)
Константа диссоциации (равновесия) при заданной температуре есть величина постоянная.
Для разбавленных растворов или для чистой воды активность можно заменить концентрациями:
KD = CH+COH-/CH 2O. (1.21)
Так как степень диссоциации воды (концентрация ионов Н, ОН - очень мала, то активность (концентрация) недиссоциированных молекул в ней остается практически постоянной. Следовательно, можно записать:
C H+COH - = kB-, (1.22)
Где постоянная KB = KD СН2О = KD, так как СН2О чистой воды = 1.
Постоянная KB называется ионным произведением воды. Вычислено, что при 22°С оно равно 10, т. е. концентрации ионов Н и ОН в воде со-
-7
Ставляют 10 грамм-ионов на 1 л (г-ион/ л).
Добавляя к чистой воде различные вещества, дающие при растворении ионы Н или ОН, можно нарушать равенство их концентраций, соблюдаемое в чистой воде. Так, введение кислот увеличивает концентрацию водородных ионов, которая становится большей, чем 10 г-ион/л. При добавлении щелочей увеличивается концентрация гидроксильных ионов. Поскольку при этом ионное произведение воды остается постоянным, то любое повышение концентрации водородных ионов вызывает соответствующее уменьшение концентрации гидроксильных ионов, и наоборот. Зная концентрацию водородных ионов в растворе, можно определить концентрацию гидроксильного иона или решить обратную задачу. Например, если в водном растворе концентрация [Н+] равна 10 г-ион/л, то [ОН] = Kb/[H+] = 10-14/10-3 = 10-11 г-ион/л. Однако в любом водном растворе ни концентрация ионов водорода, ни концентрация гидроксильных групп не может быть равна нулю, поскольку KB отлична от нуля.
Таким образом, кислотность и щелочность водного раствора. можно выразить концентрацией либо ионов Н+, либо ионов ОН. Они в этом отношении равноценны. Условились использовать концентрацию водородных ионов. Тогда для нейтрального раствора [Н+] = 10-7, для кислого [Н+]>10-7 и для щелочного [Н+]<10-7 г-ион/л (квадратные скобки означают концентрацию).
Однако применять в расчетах концентрации водородных ионов с отрицательными показателями степени неудобно, поэтому датский химик Соренсен (1909 г.) ввел понятие водородного показателя рН (по-датски potenz - математическая степень; Н - химический символ водорода).
Водородный показатель - это десятичный логарифм концентрации водородных ионов, взятый с обратным знаком. Тогда в нейтральной среде рН = 7, в кислой среде рН < 7, в щелочной - больше 7: чем меньше рН, тем больше концентрация ионов Н+, т. е. выше кислотность среды. И наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
Понятие рН среды широко применяют в различных отраслях науки и технологии (в аналитической химии, почвоведении, экологии, гидрометаллургии, очистке сточных вод, медицине и т. п.). В качестве практической значимости использования рН приведем его величины для некоторых растворов и соответствующую ему реакцию среды: желудочный сок - 1,7 (сильнокислая реакция), торфяная вода - 4 (слабокислая), дождевая вода - 6 (слабокислая), водопроводная вода - 7,5 (слабощелочная), кровь - 7,4 (слабощелочная), слюна - 6,9 (слабокислая), слеза - 7 (нейтральная). В сельском хозяйстве в зависимости от рН почвенного раствора почвы разделяют на группы: сильнокислые (рН 3.4), кислые (4.5), слабокислые (5.6), нейтральные (6.7), слабощелочные (7.8), сильнощелочные (8.9).
Законам идеальных растворов подчиняются также бесконечно разбавленные растворы. Бесконечно разбавленные растворы - это такие растворы, в которых концентрация растворенного вещества меньше любой наперед заданной малой величины.
Случаи идеальных или бесконечно разбавленных растворов являются частными. Значительно чаще встречаются растворы, образуемые компонентами, не обладающими сходными свойствами. В этом случае растворение веществ сопровождается тепловыми эффектами (выделением или поглощением теплоты), являющимися следствием взаимодействия растворенного вещества с растворителем. В некоторых случаях это взаимодействие может привести к образованию достаточно прочных соединений. Их называют сольватами или гидратами (в водных растворах).
Образование сольватов сближает растворы с химическими соединениями. Однако в отличие от последних, растворы не подчиняются закону постоянства состава, они, как и смеси, могут быть легко разделены на составные части. Таким образом, растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Лишь в некоторых случаях (выделение гидратов из растворов при кристаллизации) состав образующихся соединений (кристаллогидратов) может быть достаточно постоянным. Воду кристаллогидратов называют кристаллизационной. Кристаллогидратами являются многие природные соединения, в частности соли и оксиды: медный купорос (CuS04x5Н20), железный купорос (FeSO 4х7 Н2О), гидрогетит (Н^е- О2ХПН2О) и др.
Образование растворов в системах со сколько-нибудь интенсивным взаимодействием, помимо тепловых явлений, сопровождается также изменением объема.
Кроме того, в системах с отклонением свойств от идеальных (разбавленных) растворов зависимости, передаваемые уравнениями (1.16-1.18), строго не выполняются. В частности, могут наблюдаться отклонения кривых «давление пара - состав» от линейной зависимости (1.16) в сторону больших (положительные отклонения) или меньших (отрицательные отклонения) значений давления пара.
Образование растворов с положительными отклонениями сопровождается, как правило, поглощением теплоты и обычно увеличением объема. Противоположные указанным, зависимости наблюдают в случае отрицательных отклонений давления пара (выделение теплоты и, большей частью, уменьшение объема).
Уравнения (1.16-1.18) можно использовать для описания свойств реальных растворов, заменив в них концентрации веществ их термодинамическими активностями.
Закон распределения, сформулированный В. Нернстом, рассматривает распределение i-го вещества в системе, состоящей из двух несмеши - вающихся жидкостей. Он устанавливает, что при постоянной температуре в идеальных или в разбавленных растворах отношение концентраций С i - го компонента в одной и другой фазах является величиной постоянной:
C1/C2 = L, (1.23)
Где L - константа (коэффициент) распределения.
Коэффициент распределения не зависит от количеств растворенного вещества и обеих жидкостей. Он определяется только природой растворителя и растворенного вещества и температурой.
В неидеальных и неразбавленных растворах закон распределения выражается через активность a и коэффициент активности у i-го вещества в обеих жидкостях:
L = ax/a2 = Y1 N1/(72. N2). (1.24)
Представление о коэффициенте распределения широко используется в различных отраслях промышленности, например в металлургии при исследовании распределения элементов между расплавленными металлами и шлаками, в химической промышленности (многочисленные экстракционные процессы), при производстве полупроводниковой электроники, жаропрочных материалов, при экстракционной очистке сточных вод и т. д.
Классификация промышленных отходов (ПО), образующихся в результате производственной деятельности человека, необходима как средство установления определенных связей между ними с целью определения оптимальных путей использования или обезвреживания отходов. Обобщение и анализ …
В практике абсорбции используются несколько принципиальных схем проведения процесса. Наиболее широко применяются прямоточная (рис. 4.7,а) и противоточная (рис. 4.7,б) схемы. Абсорбция G X Z, X н G Y Xк Б) …
Биохимические методы применяют для очистки хозяйственно - бытовых и промышленных сточных вод от многих растворенных органических и некоторых неорганических (сероводорода, сульфидов, аммиака, нитритов) веществ. Процесс очистки основан на способности микроорганизмов …
msd.com.ua
растворитель, растворенное вещество. Вода как
allr.genskov.ru
Растворители
Растворители — это органические или неорганические жидкости или их смеси, применяемые для растворения различных веществ.
Растворители используются во многих отраслях химической промышленности, в производстве резиновых и резинотехнических изделий, в приборе- и машиностроении, для получения лакокрасочных материалов, в обувном и кожгалантерейном производствах, в медицинской промышленности, лабораторном деле и т. д.
Самым распространенным и универсальным неорганическим растворителем является вода. К органическим растворителям относятся углеводороды (см.), спирты (см.) и эфиры (см.), растительные и минеральные масла и др.
Различные органические растворители действуют на организм или преимущественно наркотически (см. Этиловый спирт, Ацетон), или вызывают органическое поражение нервной системы (см. Сероуглерод, Метиловый спирт), нарушение деятельности кроветворной системы (см. Бензол), преимущественное поражение печени (см. Хлорированные углеводороды). Кроме токсичности, для гигиенической оценки растворителей имеют значение летучесть (максимально возможная концентрация паров растворителей в воздухе) и способность всасываться через неповрежденную кожу. Контакт растворителей с кожными покровами сопровождается появлением сухости, трещин, дерматитов.
Профилактические мероприятия. Замещение при приготовлении клеев, лаков, красок наиболее вредных растворителей (бензола, сероуглерода, дихлорэтана, четыреххлористого углерода, авиационного бензина) менее токсичными. Механизация, автоматизация и герметизация производственных процессов с растворителями. При сохранении ручных работ — использование приспособлений и инструментов, ограничивающих разбрызгивание растворителя; применение на рабочих местах емкостей с хорошо пригнанными крышками, открываемыми по мере надобности; возможно более полное укрытие рабочих мест с оборудованием местной вытяжной вентиляции (по типу вытяжных шкафов). Запрещение пользоваться растворителем для очистки рук от загрязнений. Применение фартуков, нарукавников, защитных перчаток. Смазывание рук защитными мазями (паста ИЭР-1, крем «биологические перчатки» и др.) во время работы и ожиряющими — после окончания работы и мытья теплой водой с туалетным мылом. Предварительные и периодические медосмотры рабочих.
Растворители — это жидкости или их смеси, растворяющие газообразные, жидкие и твердые вещества. В зависимости от назначения к растворителям предъявляются различные требования: хорошая растворяющая способность, химическое постоянство, отсутствие химического взаимодействия с растворяемым веществом, соответствующие температуры кипения и замерзания, огнестойкость, малая токсичность и т. д. Растворители, используемые для медицинских и фармацевтических целей, должны обладать высокой степенью чистоты. О степени чистоты растворителей судят по прозрачности, бесцветности, температуре кипения, показателю преломления, по спектрам поглощения и др.
Растворяющая способность растворителей обычно возрастает с увеличением температуры (растворимость газов уменьшается). Кроме того, на растворяющую способность в сильной степени могут влиять примеси и добавки. Большинство растворителей гигроскопично, для их высушивания используют осушители (окись алюминия, безводные хлористый кальций, сернокислый кальций, силикагель, пятиокись фосфора и др.).
Неорганические растворители. Самым распространенным и универсальным растворителем является вода. В ней в тех или иных количествах могут растворяться почти все вещества. Вода — основной растворитель и для лекарственных веществ. Однако есть медикаменты, которые в ней практически не растворимы, а некоторые подвергаются гидролизу (см.). В водных растворах могут развиваться микроорганизмы. В качестве растворителя иногда используют ртуть, которая растворяет металлы, образуя с ними амальгамы (таблица 1).
| Наименование | t° пл | t° кип | Плотность, при 20° (г/см3) | Вязкость, при 20° (сантипуаз) |
| Вода | 0 | 100 | 0,99823 | 1,0050 |
| Ртуть | —38,89 | 357,25 | 13,5461 | 1 ,589 |
Органические растворители. К ним относятся углеводороды (см.): алифатические — пентан, гексан, гептан и др.; алициклические — циклопентан, циклогексан, декалин и др.; ароматические — бензол, толуол, ксилол и др.; смеси углеводородов — бензин, керосин, петролейный эфир (таблица 2). Углеводороды хорошо растворяют жиры, масла, смолы, каучуки и др. В воде они практически не растворяются. Они летучи и огнеопасны (пары их с воздухом могут образовывать взрывчатые смеси). Многие углеводороды токсичны (см. ниже).
Галоидопроизводные углеводороды: алифатического ряда — хлористый метилен, хлороформ, четыреххлористый углерод, дихлорэтан, трихлорэтан и др.; ароматического ряда — хлорбензол, дихлорбензол и др.— трудновоспламеняющиеся или негорючие жидкости, применяющиеся для извлечения эфирных масел из лекарственного сырья и др.
Таблица 2. Характеристика важнейших органических растворителей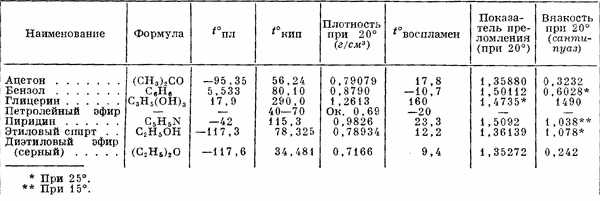
Спирты и эфироспирты: применяют обычно низшие спирты с t°кип от 66 до 205° (метиловый, этиловый, пропиловый и др.)- Они растворяются в воде в любых соотношениях и могут применяться как в чистом виде, так и в виде водных растворов. Прекрасным растворителем служит диэфир гликоля диоксан — легко подвижная жидкость, t° кипения 101,32°, смешивающаяся с водой в любых соотношениях.
Простые и сложные эфиры. Простой эфир, или этиловый эфир (см.), широко используют в медицине. Из сложных эфиров наибольшее применение имеют эфиры уксусной кислоты (этилацетат, изопропилацетат и др.). Они обладают приятным запахом, в воде нерастворимы. Используются в лакокрасочной промышленности и т. д. Кроме того, в качестве растворителей применяют амины (см.) — диметиламин, этиламин, диэтиламин и др.; аминоспирты — этаноламин (см.) и др., кетоны — ацетон (см.), метилэтилкетон и др.; гликоли — этиленгликоль и др.; органические кислоты —муравьиную кислоту (см. Метиловый спирт), уксусную кислоту (см.), пиридин и мн. др.
Для медикаментов, нерастворимых в воде, применяют в качестве индифферентных растворителей растительные масла и масла минеральные (см.). Из растительных масел в лекарствах для наружного применения используют подсолнечное, а для инъекций — персиковое масло. Для смягчения действия лекарственных веществ (йода, танина и др.) применяют глицерин (см.).
www.medical-enc.ru
Растворитель - это... Что такое Растворитель?
Растворитель (от латинского solvere, «ослабить») — жидкое, твёрдое или газообразное вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, которые растворяются в определённом объёме растворителя при заданной температуре. Обычно используются как органические растворители в химчистках (например, тетрахлорэтилен), как растворители (например, толуол, скипидар), для удаления лаков и клея (ацетон, метиловый спирт, этилацетат), в моющих средствах (цитрусовые терпены), в парфюмерии (этанол) и в химическом синтезе. Обычно растворитель и растворяемое вещество одинаковы по своей природе — подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу. Например низшие спирты растворяются в высших.
Классификация
Существуют определённые принципы классификации растворителей. Очевидна качественная классификация, основанная на природе растворителя:
- органический или неорганический
- жидкий и твёрдый
Существует так же ряд количественных и полуколичественных классификаций.
Очень часто, особенно в органической химии, возникает необходимость сравнить несколько растворителей для нахождения оптимального растворителя для кристаллизации, хроматографии, проведения реакции, получения концентрированного раствора. При этом пользуются принципами «Подобное растворяется в подобном», а также понятием о «полярности» растворителя, который тем не менее часто применяется качественно на основании специфических фактов о растворимости конкретных соединений. Абсолютного количественного показателя, характеризующего полярность, нет. Часто его оценивают при помощи: диэлектрической проницаемости растворителя, его дипольному моменту.[1] Существуют также специфические способы оценки полярности растворителя, к примеру, понятие о поляризуемости растворителя, принятой для 80 % этанола за 0.[2] В хроматографии также встречается понятие элюотропный ряд.[3] Их составляют согласно возрастанию элюирующей способности растворителя, то есть, для каждого сорбента существует свой элюотропный ряд.
 Денатурат
Денатурат См. также
Примечания
- ↑ http://www.mtu-net.ru/plastmassy/1991/ar_1991_8_Molodtsova.htm (недоступная ссылка — история)
- ↑ Днепровский А. С., Темникова Т. И. Теоретические основы органической химии. Л.: Химия, 1991. С. 242
- ↑ Лабораторное руководство по хроматографическим и смежным методам. / Ред. О. Микеш. М.: Мир, 1982. С. 184
brokgauz.academic.ru